实时追踪细胞内细胞器、囊泡等相互作用对于解析生命活动中诸多生化过程的分子机制至关重要。多色受激辐射损耗超分辨显微技术(STED Nanoscopy)具有突破衍射极限的超高分辨率、成像速度快、无需特殊的闪烁荧光基团等优势,能够提供活细胞内生物分子的精确定位,是新兴的纳米尺度亚细胞研究重要工具。然而,活细胞多色STED显微技术的广泛应用仍然受限于缺乏抗漂白的荧光基团和复杂昂贵的成像设备。
STED显微术利用一束常规激发光和一束超高强度的环形损耗光共同照射荧光基团,以实现超分辨成像。由于损耗光强度往往是激发光的数百至数千倍,导致荧光基团快速漂白。此外,每种荧光基团都需要各自的激发光和损耗光共同照射,在双色乃至多色超分辨成像时往往需要四束乃至更多的激光进行纳米尺度的精确耦合,这对成像设备光路系统的准确性、稳定性和成本都具有极高的要求。
中国科学院化学研究所方晓红团队开发的抗漂白双色荧光半导体聚合物点组合能够有效克服这些限制,并简化复杂的光路系统。他们设计合成了具有不同发射波长 (Em) 的两种荧光半导体聚合物点 (Pdots):CNPPV Pdots(Em:604 nm)和PDFDP Pdots(Em:663 nm)用于双色STED超分辨成像和活细胞示踪。这两种聚合物点纳米探针都具有高亮度、抗漂白、易于修饰靶向基团、生物相容以及大斯托克斯位移的特性,能够共用同一束激发光和损耗光进行双色超分辨成像,因此有效简化了成像光路。对两种聚合物点进行单颗粒成像,分别获得了78纳米和68纳米的超高分辨率。通过修饰链霉亲和素,聚合物点可以特异性标记细胞内外结构和靶蛋白。
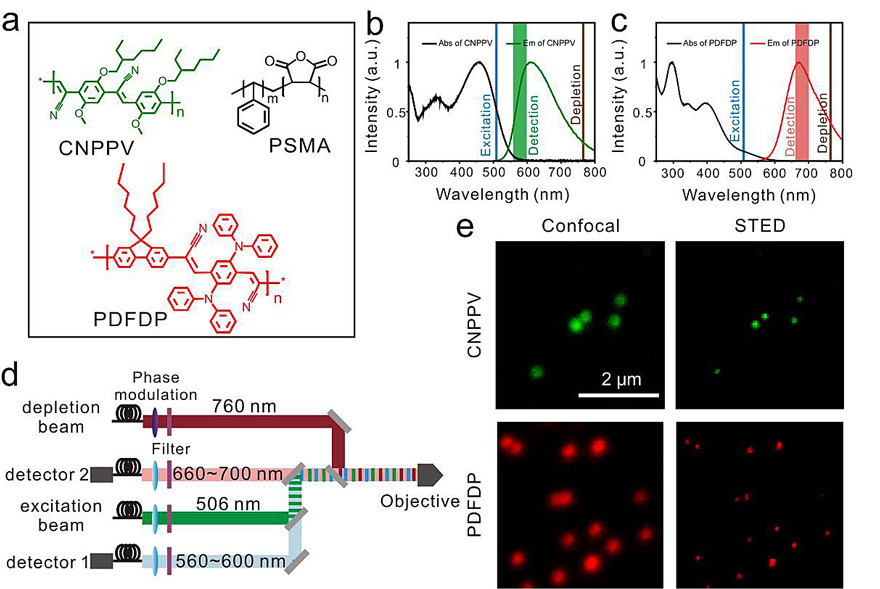
图1. 两种聚合物点颗粒的表征及STED超分辨成像。图片来源:方晓红课题组
他们将两种聚合物点探针分别标记由网格蛋白(clathrin)和小窝(caveolae)介导的内吞途径来源的内涵体,并长时间示踪其动态相互作用。由于内涵体囊泡的尺寸小于光学衍射极限(250纳米),STED超分辨成像技术能够更准确观察到内涵体囊泡间的相互作用。他们发现不同来源内涵体囊泡间存在“kiss-and-run”和“fusion-and-fission”的两种动态相互作用模式,并可以在模式间发生切换,在相互作用的同时发生了囊泡间的货物交换。据此,他们提出了新的内涵体囊泡间动态相互作用模型。
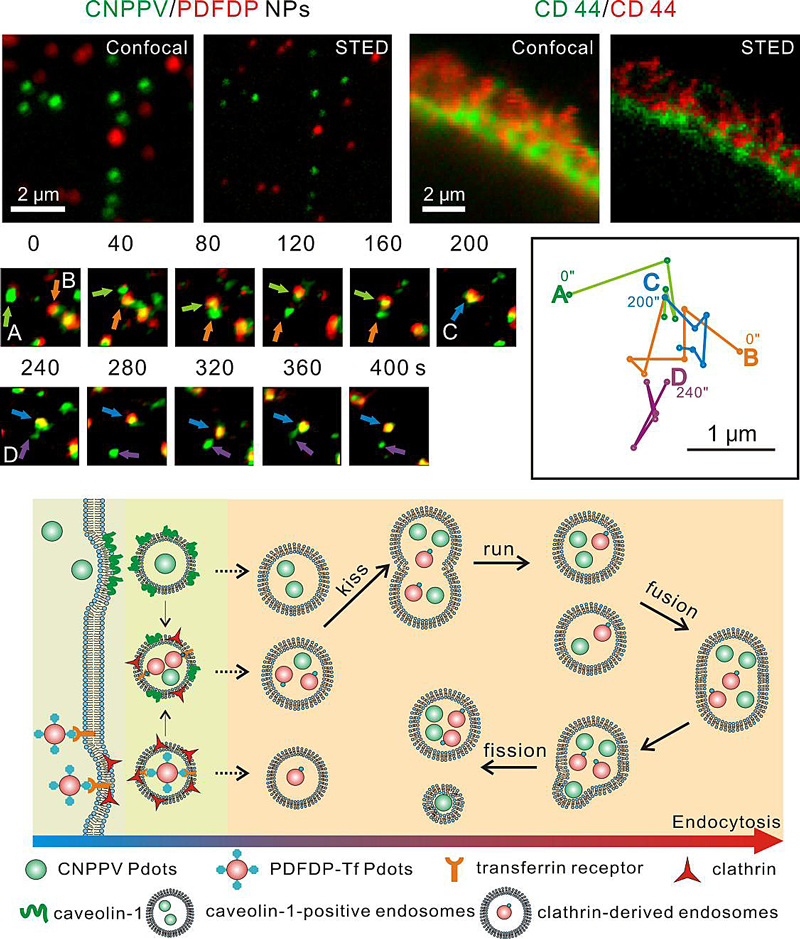
图2. 双色STED超分辨成像和活细胞囊泡动态示踪模型。图片来源:方晓红课题组
以上研究表明,荧光半导体聚合物点这类新型纳米探针在活细胞多色STED超分辨成像领域具有广阔的应用前景。这一成果近期发表在Analytical Chemistry 上。

