背景介绍
电催化反应一般涉及多步基元反应步骤,而反应过程是由基元反应中活性位点上中间物种的吸脱附平衡决定的。电催化领域研究的挑战之一是理解催化剂表面物理或者化学状态在每步基元反应中如何影响中间物种的吸脱附平衡及其对最终催化性能的影响。尽管目前不少报道探究了催化剂的外在物理特性或固有电子结构对于催化反应动力学的影响与调控,但对催化剂表面活性位点的精确设计、及其对基元反应的调控和对催化性能的影响鲜有报道。
电催化析氢反应(HER)是一种理想的模型反应来探究基元反应间的平衡与催化性能之间关系:因为(1) 研究HER对于氢能源研究具有重要意义,并且HER具有单一确定的产物;(2) 碱性HER反应动力学远慢于酸性HER,对于催化剂活性趋势与预测的研究较少;(3) 具有较明确的基元反应步骤,即H2O + e- ? Had + OH- (Volmer step)和H2O + Had + e- ? H2 + OH- (Heyrovsky step)或者Had + Had ? H2 (Tafel step)。相比于酸性HER,在碱性电解质中Volmer步骤需要合适的水分子吸附能和额外的能量解离水分子,因此形成中间氢吸附物种较困难。在电催化剂设计中引入有助于促进水解离步骤的活性位点可以提高催化性能。然而,目前这方面的研究还有待深入。水解离步骤的能垒是否以及如何影响整个反应速率;鉴于水解离后生成OHad与Had存在竞争吸附,水解离步骤与Had过程是否需要平衡;是否可以针对基元反应组合设计催化活性位点,如何调控这些位点来协同促进这两个基元反应步骤等仍需深入且系统的探究。
文章亮点
碱性HER涉及水解离与氢脱附两步基元反应。文章针对该两步基元反应设计了Ni/NiO纳米异质界面作为碱性HER双组分活性位点,系统研究了活性位点比例对基元反应步骤的调控及其对催化活性的影响,指出双组分活性位点需要平衡设计以实现高效碱性析氢。结论表明在该Ni/NiO纳米晶模型催化剂系统中,表面Ni/NiO比例在23.7%附近时,催化剂表现出最佳碱性HER性能。该发现为针对基元反应设计和开发高效催化界面,进而提高催化活性提供了依据。
图文解析
1. DFT计算Ni/NiO界面碱性HER反应步骤
首先文章对碱性HER中Ni/NiO界面的关键反应步骤进行DFT计算,包括H2O的解离反应和Had的吸附/结合。计算采用Ni(111)和氧端八面体NiO(111)表面模型。如图1a所示,在Ni(111)表面上,H2O中H-OH键断裂的能垒高达0.94 eV;而在NiO(111)表面上,水解离能垒只有0.06 eV。因此,与Ni相比,NiO表面能显著促进水的解离,增加Had的生成速率。此外,生成的Had将通过Heyrovsky或Tafel步骤结合形成H2。其中,氢吸附自由能GH已被确定为关键因素。图1b显示了在Ni(111)和NiO(111)表面上计算的GH结果。可见NiO(111)表面上GH远大于最优值(GH = 0),说明生成H2异常困难;而Ni(111)表面上GH要小得多,更接近最优值。表明Had更易于在Ni(111)表面形成H2。
这些DFT分析表明Ni/NiO异质结构是一种适合于碱性HER的协同催化剂,其中H2O分子适于吸附并在NiO表面分解成Had和OHad;然后Had可以转移或溢流至在附近Ni位点上转化为H2(Fig. 1c)。挑战在于如何实现和调控这样的Ni/NiO纳米异质界面,是否存在及如何获得Ni和NiO组分的最优比例以平衡两步基元反应步骤,从而实现最佳碱性HER活性(Fig. 1d)。
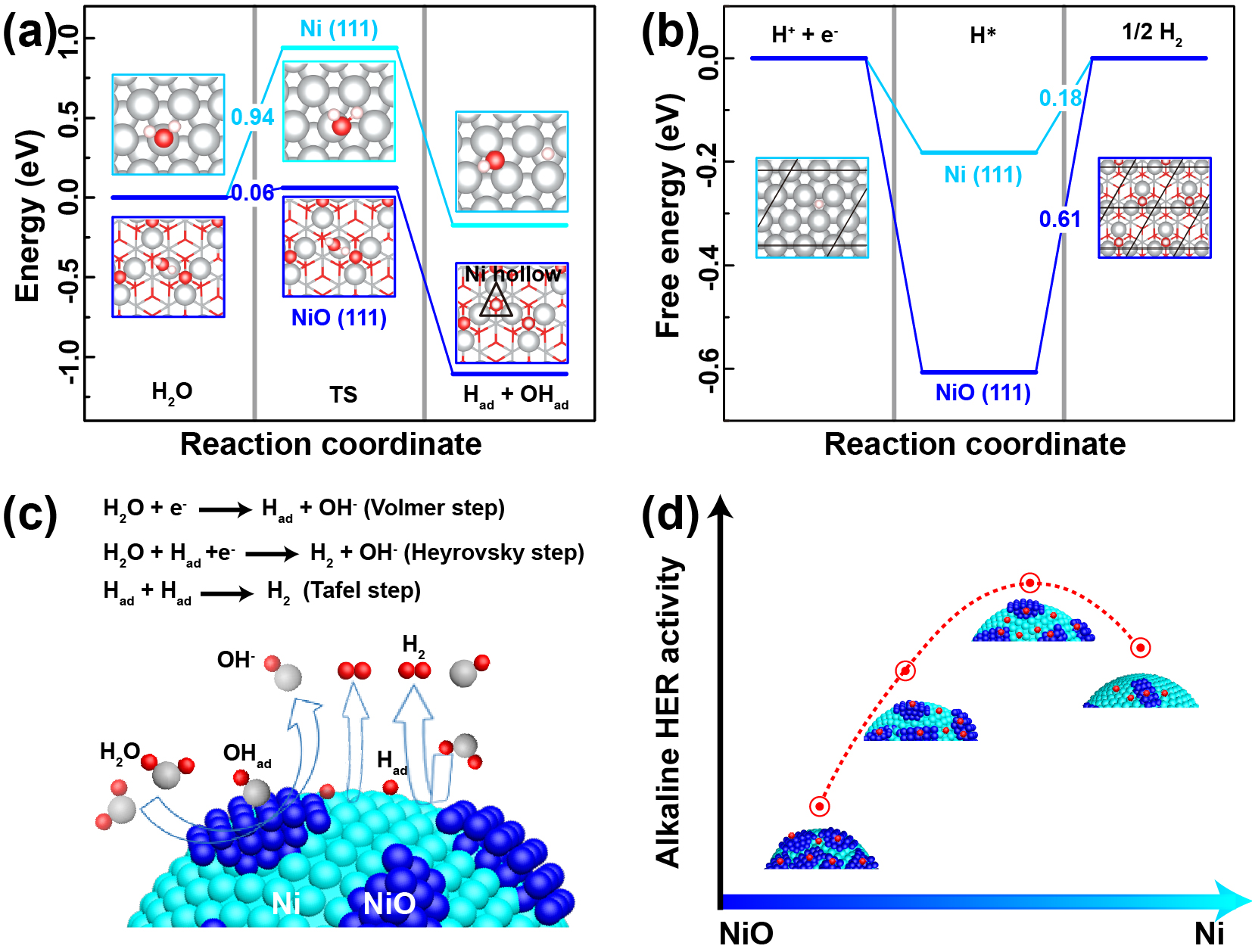
Figure 1. DFT calculations. (a) The energy barrier for breaking the OH-H bond in the Volmer step (water dissociation) and (b) the free energy diagram for hydrogen adsorption (GH) on Ni (111) and NiO (111) surfaces in the Heyrovsky step. Gray, red, and small white spheres represent Ni, O, and H atoms, respectively. (c) Schematic illustration of alkaline HER on Ni/NiO heterosurfaces. (d) Dependence of alkaline HER activity on the surface compositions of Ni/NiO heterosurfaces.
2. Ni/NiO纳米异质界面结构表征
文章发展了一种通过合成时控制Ni纳米晶尺寸,利用Ni纳米晶自然氧化的尺寸相关性来精确调控纳米晶表面Ni/NiO比例的方法,成功制备得到一系列Ni/NiO纳米异质界面可调的高度分散的Ni/NiO纳米晶模型催化剂。从TEM图像(图2a-d)中可以看出,每种纳米晶都高度均匀地分散在碳基底上。纳米晶的粒径分布分析平均粒径分别为0.7、2.7、3.8和6.1 nm。利用高角度环形暗场像差校正扫描透射电镜(HAADF-STEM)技术,表征了这些纳米晶上具有明显特征的原子尺度结构信息。图2f-h显示了核与周围壳层的强烈对比,说明了2.7 ~ 6.1 nm纳米晶具有纳米级异质界面。在纳米晶核部分,原子排列有序,结晶性好,可归属为金属镍;在壳层中观察到大量的缺陷和晶界。金属的表面自由能随着纳米晶尺寸的减小而急剧增大,反应活性增高。在自然氧化过程,越小的纳米晶越容易被氧化,疏松的自然氧化层更厚。以Ni/NiO-3.8为例,图2i放大TEM图显示晶面间距0.21和0.18 nm,夹角为54.7°的区域对应于面心立方(fcc)Ni(JCPDS No.04-0850)的(111)和(200)平面;多孔壳体上间距为0.24 nm的晶格条纹可归属于(fcc)NiO (JCPDS No. 47-1049)的(111)面。电子能量损失谱也验证了Ni/NiO纳米异质界面的存在。
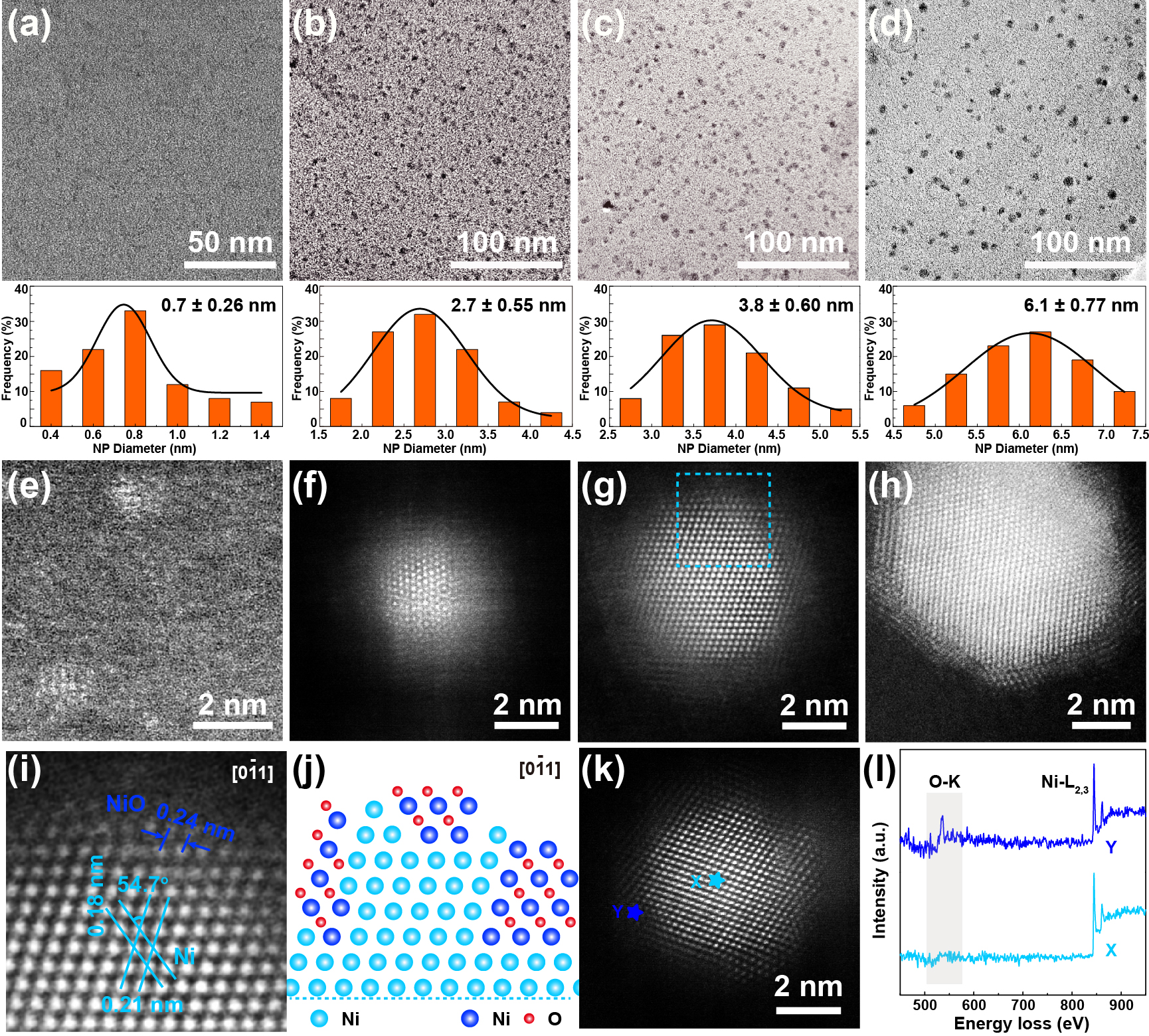
Figure 2. Structural characterizations. (a-d) Typical TEM images of Ni/NiO nanocrystals in different sizes: (a) 0.7, (b) 2.7, (c) 3.8, and (d) 6.1 nm. Below: corresponding histograms of size distribution. (e-h) Typical HAADF-STEM images of Ni/NiO nanocrystals shown in (a-d), respectively. (i) Zoom-in HAADF-STEM image as marked by the square in (g). (j) Schematic illustration of heterostructure of Ni/NiO. (k) Typical HAADF-STEM image for EELS analysis and the corresponding Ni-L and O-K EELS spectra (l) of Ni/NiO-3.8. Spectra were collected on the point X and Y as marked in (k).
3. 探究Ni/NiO纳米晶表面Ni/NiO界面双组分比例调控及其与碱性HER活性关系
XRD图谱(图3a)中44.5,51.8和76.4°处的弱峰分别归属于镍(111),(200)和(222)晶面。随着纳米晶尺寸的减小,三个峰的强度逐渐减小,甚至消失。所有样品中均未观察到NiO信号,表明其低的结晶性。图3b的拉曼光谱中在440、565、770和1108 cm-1处有4个特征峰,分别对应于NiO的一阶横向光学(TO)、纵向光学(LO)、2TO和2LO振动。这些振动的相对强度随着纳米晶尺寸的减小而逐渐增强,说明NiO含量逐渐增加。高分辨Ni 2p XPS光谱(图3c)中清晰观察到Ni0 (852.9 eV和870.9 eV)和Ni2+ (856.2 eV和874.6 eV)峰。随着纳米晶粒径的减小,Ni2+信号强度增强,即NiO含量增加,与STEM、XRD、Raman分析结果吻合。拟合结果表明Ni/NiO-0.7、-2.7、-3.8和-6.1中Ni/NiO比值分别为0、13.2、23.7和59.5%。
碱性HER测试极化曲线和分析表明(图3d和3e)Ni/NiO比例接近于0(Ni/NiO-0.7)时
起始电位为305 mV,在电流密度为10 mA cm-2时过电位为401 mV,性能极差,主要是由于虽然有足够的NiO进行第一步Volmer步骤,但缺乏活性成分Ni进行Tafel(和/或Heyrovsky)步骤。随着Ni/NiO比值的增加,HER活性增强。当Ni/NiO比例增加到23.7%, Ni/NiO-3.8达到最优的HER催化活性,起始电位为11 mV,在电流密度为10 mA cm-2时,过电位仅为90 mV,接近于商业Pt/C催化剂和优于最近报道镍系催化剂(Fig. 3f)。进一步提高Ni/NiO比值,Ni/NiO-6.1的活性在59.5%的比值下降低,说明Ni/NiO比值越高,Ni/NiO对其催化越不利。这种催化活性的降低应归因于NiO活性成分不足以进行Volmer步骤,尽管它在Tafel(或Heyrovsky)步骤中具有丰富的Ni活性成分。如Fig. 3g所示,这些样品的Tafel斜率趋势与催化活性的发展趋势是一致的,再次说明了HER活性依赖于Ni/NiO纳米级界面。此外,分析该体系中的Tafel斜率发现,碱性HER通过Volmer-Heyrovsky机制作用于我们开发的模型催化剂上。为了排除活性位点数对其活性的影响,计算了4个样品在200 mV过电位下的TOF值,如Fig. 3h所示, Ni/NiO-3.8样品的TOF值最高,为0.95 s?1,Ni/NiO-0.7最低,为 0.0078 s?1,这也进一步证实了Ni/NiO界面与其HER活性的关系。稳定性测试表明Ni/NiO-3.8在5000 CV循环后衰减很小(Fig. 3i)。
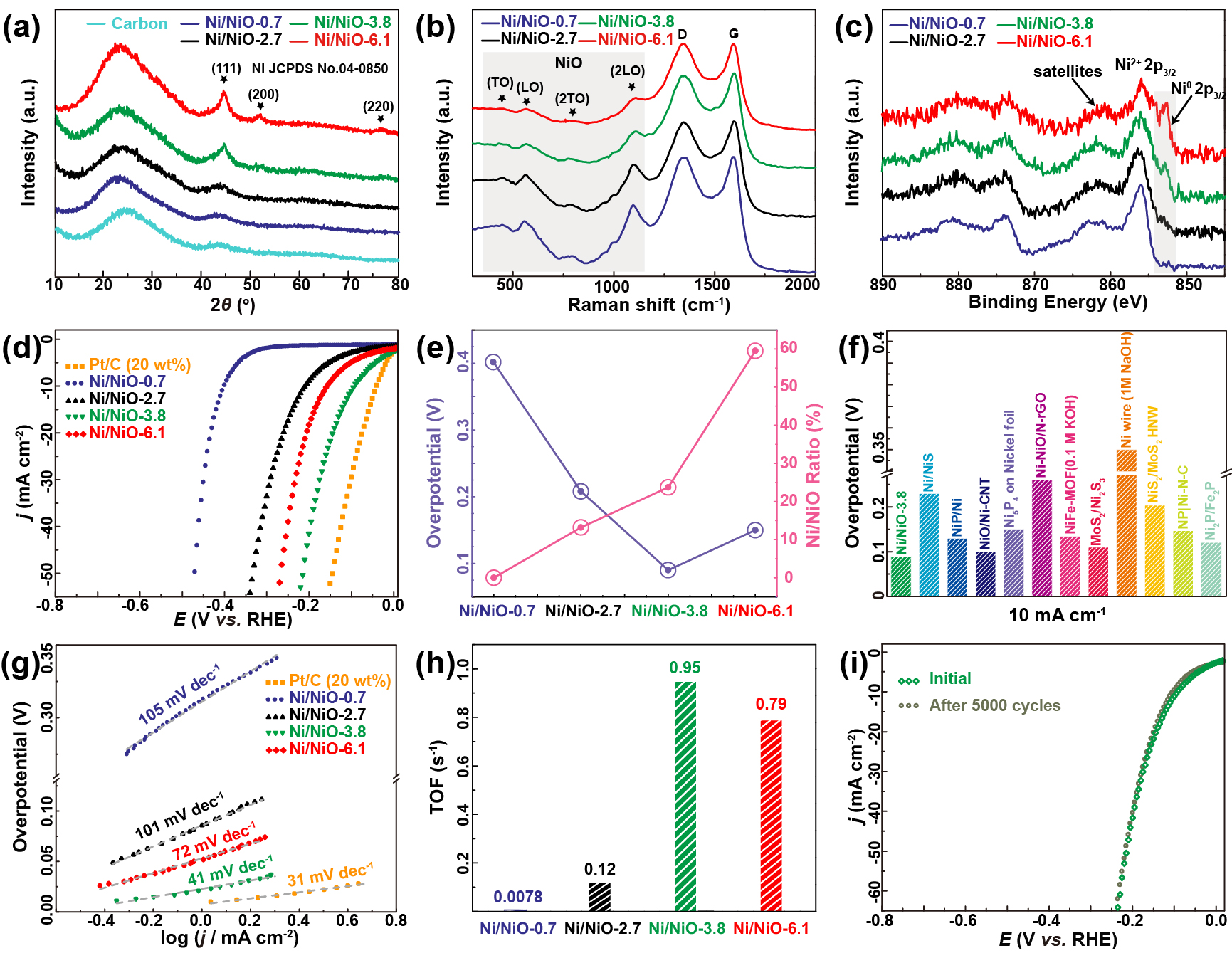
Figure 3. Spectroscopic characterizations and electrocatalytic performance for HER. (a) XRD patterns, (b) Raman spectra, and (c) High-resolution Ni 2p XPS spectra of Ni/NiO nanocrystals. (d) Polarization curves and (e) the relationship between overpotentials at 10 mA cm?2 and Ni/NiO ratio of Ni/NiO-0.7, -2.7, -3.8, and -6.1. (f) Overpotential comparison of Ni/NiO-3.8 with state-of-the-art Ni-based HER catalysts. (g) Tafel plots and (h) turn-over frequency (TOF) (at 200 mV overpotential) of different Ni/NiO nanocrystals. (i) Polarization curves before and after 5,000 CV cycles of Ni/NiO-3.8. The benchmark Pt/C catalyst was also evaluated in (d and g) for comparison.
4. 进一步探究不同Ni/NiO界面的碱性HER活性
我们猜测Ni/NiO样品界面组分比例的不同导致HER活性的显著差异。首先纳米晶大小分别固定在3.8和6.1 nm,然后通过精细控制氧化温度让其表面原位氧化,对Ni/NiO比例进行精确调控(Figs. 4a,d)。对于Ni/NiO-3.8催化剂,在100和200℃氧化后,Ni/NiO比例从23.7降至11.5%~0 (Fig. 4b)。拉曼光谱证实了随着氧化温度升高,NiO含量增加。电化学测试表明,随着Ni/NiO比例的减小,其HER活性降低,类似与Ni/NiO-0.7和-2.7。此外,对于Ni/NiO-6.1催化剂,在100和150℃氧化后,Ni/NiO比例从59.5降至27.8和15.8% (Fig. 4e)。然而,当Ni/NiO比值降低到20%左右时,HER的活性得到改善,比例进一步降低时,活性显著下降(Fig. 4f)。值得注意的是Ni/NiO-6.1@100 oC比Ni/NiO-3.8比例稍高(27.8% vs. 23.7%),而其活性(138 mV@10mA cm-2)和TOF(扣除活性位点数影响,0.92 s-1)略低于Ni/NiO-3.8 (90 mV@10mA cm-2, 0.95 s-1)。与Ni/NiO-3.8比较,Ni/NiO-6.1@150℃中Ni/NiO比例为15.8%时,其HER活性急剧下降。这些结果表明,对于碱性HER而言,在Ni/NiO纳米晶中Ni/NiO最佳表面比例应该接近于Ni/NiO-3.8双组分比例(23.7%)。NiO组分太多会导致Ni活性位点不足以进行Heyrovsky步骤。NiO上由水解离产生过量的OHad亦会限制Had的吸附,导致H2形成效率低下。另一方面,如果Ni组分过多,水解离(Volmer步骤)成为决速步骤,导致Had的形成速率降低。因此,分别负责碱性HER不同基元反应步骤的两个组分应该达到平衡,以达到最高的HER活性。在我们设计的模型催化剂中,Ni/NiO的最优比例约为20%左右。
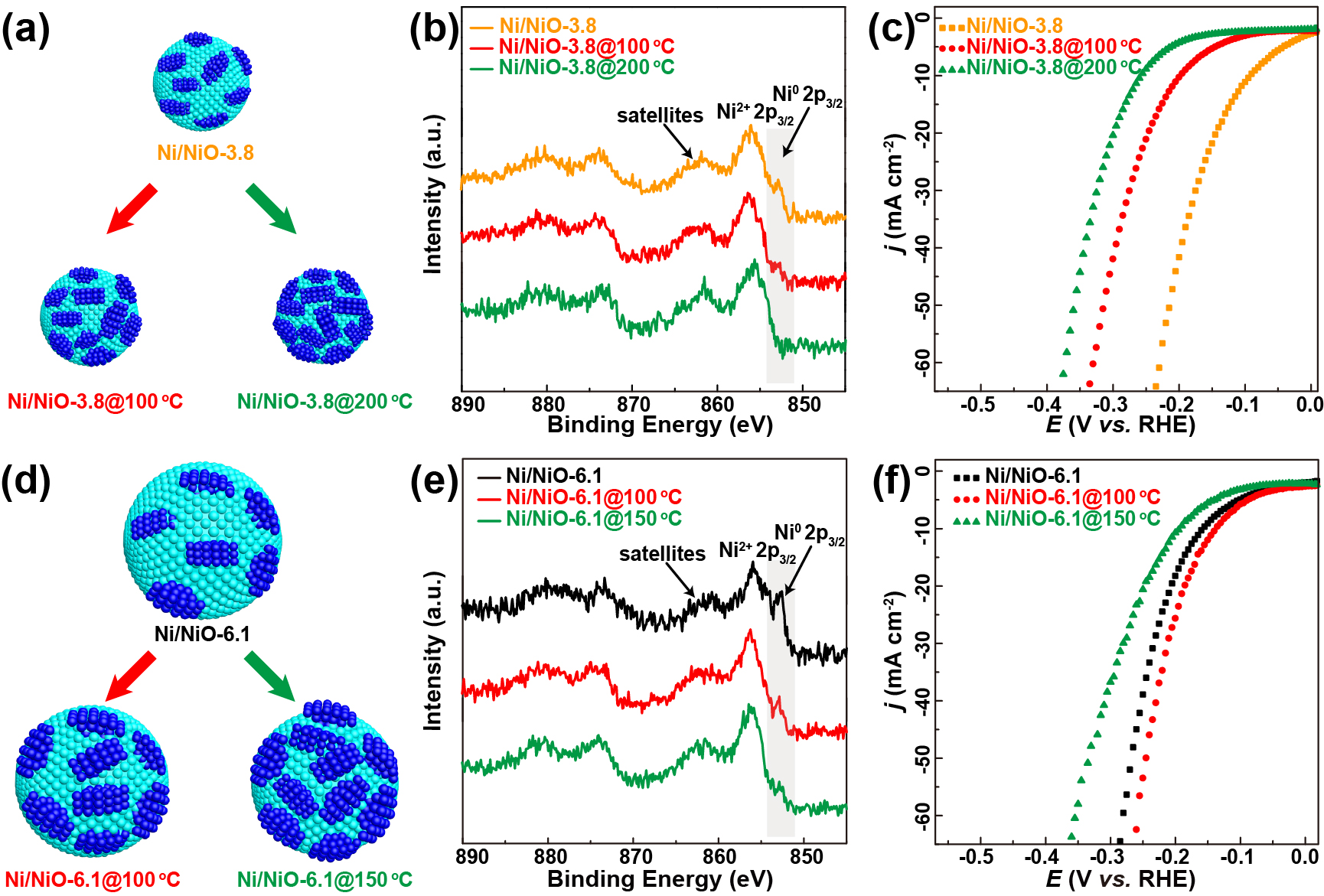
Figure 4. Modulation of surface chemistry and the influence on HER activity. Schematic illustrations of the surface modulations on (a) Ni/NiO-3.8 and (d) -6.1 by controlled post-oxidization, respectively. (b and e) High-resolution Ni 2p XPS spectra and (c and f) polarization curves of Ni/NiO-3.8 and -6.1 with different oxidation degrees, where the suffix after the sample name represents the oxidation temperature.
总结与展望
综上所述,我们系统地研究了Ni/NiO双组分模型催化剂对碱性HER活性的影响。DFT计算结果表明,NiO组分可以加速水解离而Ni组分的存在促进了吸附物种Had生成H2。通过对Ni/NiO纳米晶尺寸控制,自然氧化和原位氧化处理,成功制备得到一系列具有不同Ni/NiO界面比例的高分散的模型催化剂。系统的电化学测试表明碱性HER活性与Ni/NiO纳米级异质界面组成密切相关,两种组分应该平衡达到最佳性能。碱性HER活性与Ni/NiO比值关系的火山曲线表明,平均尺寸为3.8 nm的Ni/NiO纳米晶具有最佳的Ni/NiO比值(~20%),很好地平衡Volmer和Heyrovsky/Tafel两步基元反应,从而表现出最优的碱性HER活性和稳定性。我们的工作为设计和开发提高碱性HER活性的高效催化界面,深入了解其催化机理提供很好的契机。
文献链接
Steering Elementary Steps towards Efficient Alkaline Hydrogen Evolution via Size-Dependent Ni/NiO Nanoscale Heterosurfaces. Natl. Sci. Rev. 2020, 1, nwz145.
https://doi.org/10.1093/nsr/nwz145

